
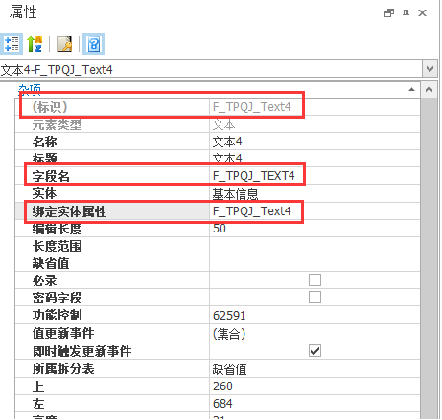
包膜病毒通过从它们侵入的细胞中萌芽来获得外层。CRISPR-Cas9研究人员利用这种行为来生产包裹Cas9蛋白(深绿色)的包膜衍生载体,引导RNA和转基因。这些负载载体靶向并侵入特定类型的人类T细胞,在那里它们同时编辑和插入新基因,将T细胞变成癌症战士。图片来源:Jenny Hamilton,IGI/加州大学伯克利分校
靶向抗体的“包膜递送载体”选择性地编辑 T 细胞以产生 CAR T 细胞。
目前大多数获批的基因疗法,包括涉及CRISPR-Cas9的基因疗法,都对从体内取出的细胞施展魔力,然后将编辑后的细胞返回给患者。
该技术是靶向血细胞的理想选择,目前是新批准的用于镰状细胞性贫血等血液疾病的CRISPR基因疗法的方法,其中编辑的血细胞在骨髓被化疗破坏后重新输注到患者体内。
CRISPR-Cas9递送的进展
1月11日发表在《自然生物技术》(Nature Biotechnology)杂志上的一种新的CRISPR-Cas9精确靶向递送方法,可以在体内时对非常特定的细胞亚群进行基因编辑,这是朝着可编程递送方法迈出的一步,该递送方法将消除在给予患者编辑的血细胞之前消灭患者骨髓和免疫系统的需要。
这种递送方法由加州大学伯克利分校的CRISPR-Cas9基因组编辑的共同发明人Jennifer Doudna的实验室开发,涉及将Cas9编辑蛋白和引导RNA包裹在一个膜泡中,该膜泡中装饰着单克隆抗体片段,这些单克隆抗体片段位于特定类型的血细胞上。
探索包膜病毒包膜
作为演示,创新基因组学研究所(IGI)杜德纳实验室的CRISPR研究员詹妮弗·汉密尔顿(Jennifer Hamilton)靶向免疫系统的一个细胞 – T细胞 – 这是革命性癌症治疗的起点,称为嵌合抗原受体(CAR)T细胞疗法。汉密尔顿和她的同事们治疗了配备人源化免疫系统的活小鼠,并将其人类T细胞转化为CAR T细胞,能够锁定并消除另一类免疫细胞,即B细胞。
汉密尔顿说,这一壮举证明了原理,显示了使用这种载体方法(包膜递送载体)来靶向和编辑活体动物(体内)以及最终人类中的血细胞和潜在其他类型的细胞的潜力。
“我们的方法涉及多路复用靶向分子,也就是说,在我们的粒子上有两个或多个靶向分子,这些分子与靶细胞相互作用,有点像计算机中的AND门,”汉密尔顿说,他指的是仅在两个事件同时发生时才起作用的逻辑电路。“当颗粒使用两种抗体配体相互作用结合时,我们能够获得更有效的递送。在用T细胞靶向载体治疗小鼠后,我们在感兴趣的细胞类型T细胞中观察到基因组工程,而不是在肝细胞中。
她说,对于所有将基因递送到细胞中的方法来说,高度特异性的靶向都是困难的。特别是肝细胞,经常占据指向其他地方的递送载体。
汉密尔顿和她的团队正在研究几种提供基因疗法的实验技术之一。许多人使用封装病毒的外层 – 病毒被清空并塞满纠正性转基因或基因编辑工具,如CRISPR-Cas9。其他方法,包括IGI研究人员正在探索的方法,依赖于将细胞穿透的Cas9蛋白直接注射到小鼠体内以实现基因组编辑。
汉密尔顿在攻读博士学位时研究了流感等包膜病毒,她专注于设计这类病毒,因为它们具有更灵活的外层,由它们萌芽的细胞外膜组成。
在 2021 年的一篇出版物中,她证明了 HIV-1 病毒的外部包膜,该病毒已被内脏并充满 Cas9,她称之为病毒样颗粒 (VLP),可以编辑培养物(体外)中的 T 细胞并将它们转化为 CAR T 细胞。从那时起,她对病毒包膜进行了如此多的改变,以至于她现在将它们称为包膜递送工具或EDV。
EDV的一个关键方面是,它们的外包膜可以很容易地用多个抗体片段或靶向配体进行装饰,这大大提高了靶向特异性。其他基因递送载体,如腺相关病毒和脂质纳米颗粒,已被证明更难精确靶向。
“人们正在努力重新靶向所有这些载体,使其对一种细胞类型具有特异性,并将它们去靶向其他细胞类型,”汉密尔顿说。“你可以显示抗体或抗体片段,就像我们一直在做的事情一样,但旁观者细胞的吸收率仍然很高。您可以将递送偏向于一种细胞类型,但您仍然可以观察到旁观者细胞的摄取。在我们的论文中,我们实际上在肝脏中观察我们是否得到了脱靶递送,但没有看到任何结果。我认为,用更传统的无包膜病毒载体或脂质纳米颗粒实现这一目标将更具挑战性。
体内CRISPR CAR T细胞疗法
在这篇论文中,汉密尔顿和她的同事们试图在体内复制一种成功给予癌症患者的离体CRISPR CAR T细胞疗法,该疗法于2020年发表在《科学》杂志上。该疗法不仅为靶向癌细胞的受体提供了转基因,而且使用CRISPR敲除了不靶向癌症的受体。
加州大学伯克利分校的研究人员成功地敲除了天然T细胞受体,并为靶向B细胞的受体(癌细胞的代理)提供了转基因。由于 Cas9 蛋白与转基因一起在同一个 EDV 中递送,因此它的寿命比递送 Cas9 基因的方法短,这意味着更少的脱靶编辑。
“我们在这篇论文中试图实现的目标,”汉密尔顿说,“跳过了必须在体外设计细胞的整个步骤。我们的目标是系统地施用一种单一载体,该载体可以在体内的特定细胞类型中进行基因递送和基因敲除。我们使用这种递送策略在体内制造基因编辑的CAR T细胞,希望我们能够简化用于在体外制造基因编辑CAR T细胞的复杂过程。
未来方向和可访问性
Doudna和她的实验室继续提高EDV介导的递送效率。汉密尔顿(Hamilton)曾是杜德纳(Doudna)实验室的博士后研究员,作为IGI的“女性创业科学”(Women in Enterprising Science)计划的研究员,他正在进一步开发这种递送方法。该实验室专注于体内起作用的载体的最终原因是使CRISPR疗法更广泛地获得和更便宜。在《连线》杂志最近的一篇文章中,杜德纳提到了当今昂贵的基因疗法的不公平性,部分原因是患者接受骨髓移植时需要延长住院时间。
“镰状细胞病的治疗预计每位患者的成本将超过200万美元,而美国只有少数机构具有提供这种治疗的技术能力,”Doudna写道,她因共同发明CRISPR-Cas9基因组编辑而获得2020年诺贝尔化学奖。“允许体内递送基因编辑疗法和改进生产的新技术将是降低价格的关键,大学、政府和行业之间独特的伙伴关系也将是将可负担性作为共同目标的关键。仅仅制造工具是不够的。我们必须确保它们到达最需要它们的人手中。



















暂无评论内容